【目次】
1. はじめに
2. ナマコに着想を得たマイクロニードル神経導管:神経修復と再生への応用
3. 乳がん治療のためのミトコンドリア標的マイクロニードル
4. まとめ
1. はじめに
科学技術の急速な進化に伴い、3Dプリンティング技術はさまざまな産業で深く浸透し、融合しています。医療分野においては、カスタム医療機器や手術ガイド、オーダーメイドインプラントの精密設計・製造に革新をもたらすだけでなく、組織工学、オルガノイド・臓器チップの構築、個別化薬剤開発、精密ドラッグデリバリーなど、幅広い可能性を秘めています。
最先端の医療分野の探求において、BMFのPμSL技術に代表されるクロススケールかつマイクロメートル級の高精度3Dプリンティング技術は、2μmという超高精度を誇ります。この技術は、ハイスループットバイオチップ、高精度オルガノイドチップ、高性能な生体模倣微針などのデバイス製造に広く活用されています。
本稿では、BMF microArch®シリーズの装置が研究開発に貢献し、『ACS Nano』に発表された精密医療分野の画期的な2つの研究成果をご紹介します。
lバイオミメティック・マイクロニードル神経導管(MNGC) ー ACS Nano, 2024
lミトコンドリア標的マイクロニードル(HDT-Z@MNs) — ACS Nano, 2025

図1 BMF装置による医療関連部品
2. ナマコに着想を得たマイクロニードル神経導管:神経修復と再生への応用
研究内容
末梢神経損傷(Peripheral Nerve Injury, PNI)は、交通事故、戦傷、労働災害、医療事故などによって引き起こされる一般的な外傷性疾患です。損傷した神経が支配する部位では、感覚および運動機能の障害が生じ、患者に大きな苦痛と不便をもたらします。PNIは患者の生活の質を著しく低下させるだけでなく、社会的・経済的にも重い負担を与える疾患です。
PNIの治療法は外科的治療と非外科的治療の2種類に大別されます。
非外科的治療には、電気刺激(Electrical Stimulation, ES)、磁気刺激、レーザー光治療などが含まれます。
外科的治療には、神経縫合術(Neurorrhaphy)や神経移植術(Nerve Transplantation)があり、神経移植には自家移植(Autologous)と同種移植(Allogeneic)があります。
このうち、自家神経移植は現在「ゴールドスタンダード」とされていますが、ドナー部位の不足や、術後の変形・腫瘍形成などのリスクが問題となっています。さらに、PNIにはしばしば筋萎縮(Muscle Atrophy)が併発し、神経機能の回復を妨げ、既存治療法の効果を著しく制限します。
こうした課題を解決するため、Zengjie Fanらの研究チームは、ナマコの生理学的特性と解剖学的特徴に基づき、ナマコを模倣したマイクロニードル神経導管(Microneedle Nerve Guidance Conduit, MNGCs)を設計・開発しました。このMNGCsは、末梢神経損傷とそれに起因する筋萎縮の相乗的かつ効率的な治療することを目的とした新しい生体工学的デバイスです。
本研究成果は「Sea Cucumber-Inspired Microneedle Nerve Guidance Conduit for Synergistically Inhibiting Muscle Atrophy and Promoting Nerve Regeneration」というタイトルで、国際学術誌《ACS Nano》に掲載されました。
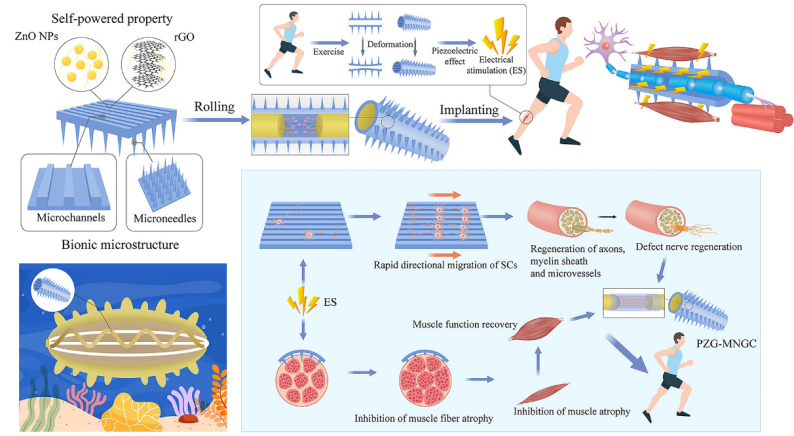
図2 MNGCsの設計、作製及び併用療法の概念図
MNGCsのデザインは、ナマコからインスピレーションを得ています。ナマコの体表には円錐状の疣足(conical verrucous feet)が規則的に並び、体内には豊富なコラーゲンが含まれており、その非対称な結晶構造が圧電効果を生み出しています。
MNGCsは、ポリカプロラクトン(polycaprolactone, PCL)を基質とし、これに還元型酸化グラフェン(Reduced Graphene Oxide, rGO)と酸化亜鉛ナノ粒子(ZnO NPs)を混ぜ込むことで、それぞれ導電性と圧電性能を付与し、変形時に電刺激を発生できるように設計されています。
構造的には、外側はマイクロニードル(MNs)となっており、筋肉に刺入して電刺激を伝達することで筋萎縮を抑制します。一方、内側にはマイクロチャネル(微小管)が設けられており、シュワン細胞(Schwann cell, SCs)の定向移動を誘導し、神経再生を促進します。
図3に示されているように、BMF microArch® S230装置を用いてマイクロニードルとマイクロチャネルのテンプレート(図3aの黄色テンプレート)を作製しました 。マイクロニードルをテンプレートとしてPDMS(ポリジメチルシロキサン)に転写し、図3aの青色のモールド(鋳型)を作製します 。このモールドにPG (PCL/rGO) または PZG (PCL/ZnO/rGO) の複合材料を注入し、二次転写を行うことで マイクロニードル(MNs)を作製します 。MNsの基底背側では、黄色のテンプレートを用いてマイクロチャネルを構築し、冷却・固化後に取り出して管状に巻くことでMNGCsが得られます。
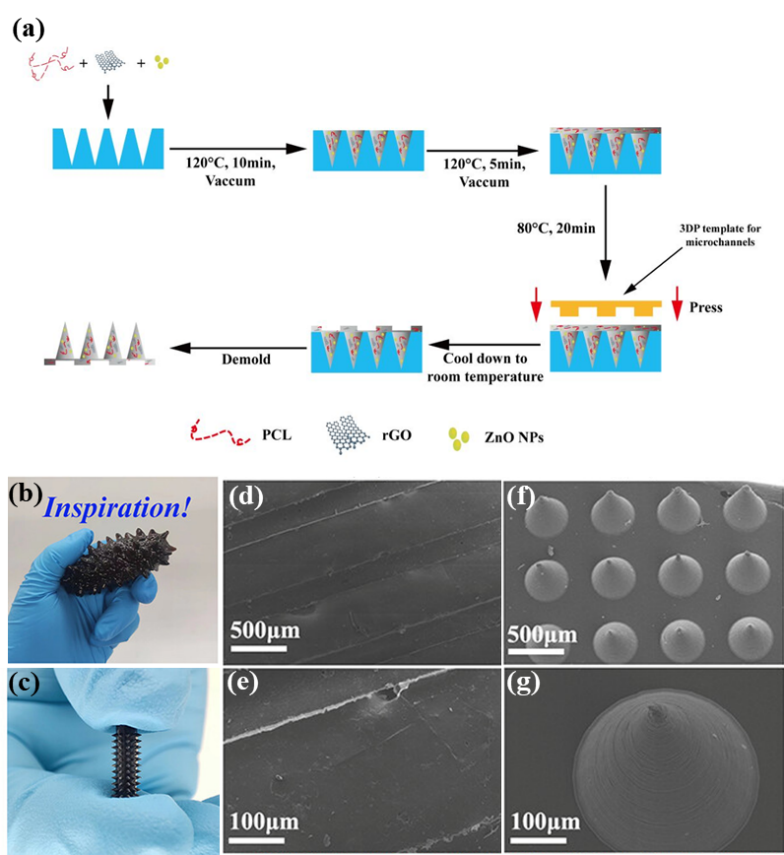
図3 MNGCsの製造プロセス及び光学画像
MNGCsの理化学的組成、マクロ・ミクロ形態、および力学性能を系統的に分析した結果、マイクロニードルとマイクロチャネルの構造が完全であり、そのマクロな形態がナマコと高度に一致していることが確認されました(図3参照)。力学テストでは、導管の主体が良好な引張性能を備え、神経を安定して橋渡しでき、断裂しないことが示されました 。
PGおよびPZG製の微針は十分な圧縮強度を持ち、筋肉に効果的に刺入できるため、電刺激の効率的な伝達に有利な条件を作り出すことが証明されました。
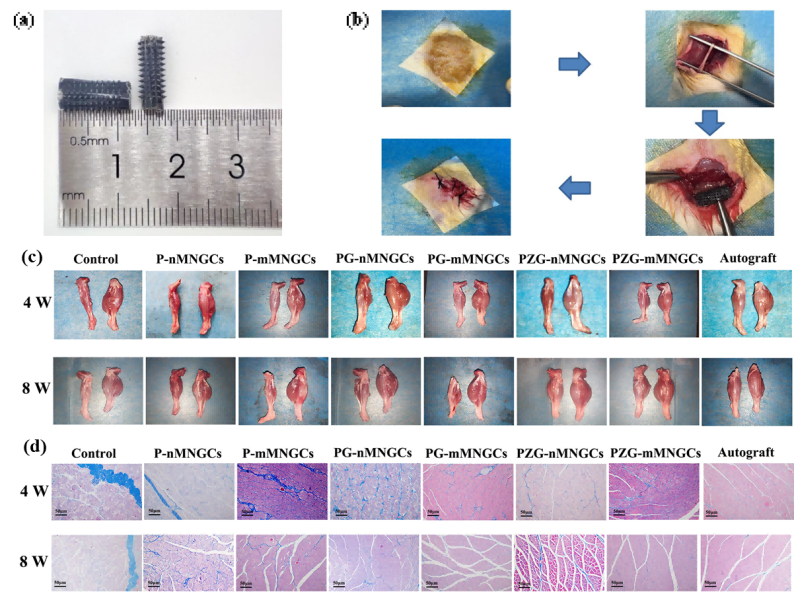
図4 MNGCsをラットに移植した模式図及びMNGCsによる筋萎縮緩和の体内効果
体外実験(in vitro)の結果、マイクロチャネルがシュワン細胞(Schwann cell, SCs)の定向配列と増殖を誘導し、さらに電刺激と導電性の微小環境がその移動プロセスを協調的に促進し、神経修復を著しく加速させることが示されました 。
生体内実験(in vivo)の結果、ラット体内モデルを用いて、患側と健側の腓腹筋(gastrocnemius muscle)を比較した結果(図4c):肉眼での観察および腓腹筋の湿重量比のいずれにおいても、PZG-MNGCs群の筋萎縮の程度が自家移植治療の効果に最も近いことが示されました 。
また、Masson染色(マッソントリクローム染色)の結果、PZG-MNGCs群の腓腹筋は筋繊維の面積が最も高く、コラーゲン繊維の面積が最も低く、PNIによって引き起こされる筋萎縮の緩和にPZG-MNGCsが最も効果的であることがさらに証明されました 。
PZG-MNGCs群は、軸索(axon)再生、髄鞘(myelin)形成、および微小血管新生においても最適な神経修復効果を示しました 。これは主に、電刺激を通じて導電性微小環境を改善し、軸索と髄鞘の再生を促進することで、神経再生をさらに促進するためです 。
研究意義
本研究は、3Dプリンティング技術と精密医療の理念を密接に結びつけました 。デジタル設計とマイクロナノ3Dプリンティング技術を通じて、生体模倣のマイクロニードルとマイクロチャネル構造を持つ神経誘導管をカスタム構築し、神経再生の微小環境を精密に制御することを実現しました 。
電刺激と構造的誘導の協調作用により、神経再生を促進し筋萎縮を抑制するとともに、自家移植治療に匹敵する治療効果を達成し、末梢神経損傷の修復に向けた革新的な解決策を提供しました。
3. 乳がん治療のためのミトコンドリア標的マイクロニードル
研究内容
乳がん(Breast Cancer)は、世界中の女性において最も多く発症するがんであり、全がんの中でも発症率が第2位に位置しています。世界保健機関(WHO)のデータによると、2022年の乳がん新規症例は約230万件、死亡者数は約67万人に達しました。
近年、外科手術、化学療法、分子標的療法などの治療法が進歩している一方で、腫瘍の転移(tumor metastasis)、進行期での診断、化学療法耐性といった課題が依然として治療効果を大きく制限しています。
抗がん剤のひとつであるドキソルビシン(Doxorubicin, DOX)は高い抗腫瘍活性を有し、乳がん治療に広く用いられていますが、心臓・肝臓・腎臓への強い毒性を伴い、さらに患者の約50%が耐薬性を示すことが報告されています。これにより、治療効果が急速に低下するという深刻な問題が生じています。
この課題を解決するため、Wei Liらの研究チームは、ミトコンドリア(Mitochondria)を標的とする新しいドラッグデリバリー・マイクロニードルシステム(HDT-Z@MNs)を開発しました。このシステムは、抗がん薬DOXを含むナノ粒子を腫瘍部位に精密に送達し、ミトコンドリアに蓄積させることで、がん細胞の「死のスイッチ」を正確に作動させ、化学療法耐性を打破する革新的な治療戦略です。
本研究成果は、国際学術誌 《ACS Nano》に「Mitochondria-Targeted Microneedles Reverse Doxorubicin Resistance via Apoptosis-Ferroptosis Synergy」というタイトルで掲載されました。
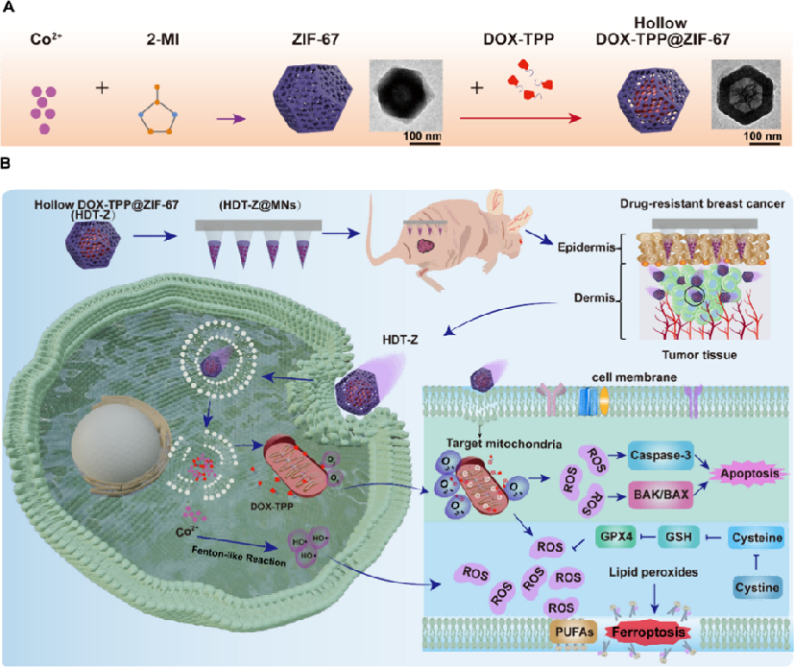
図5 化学療法耐性を克服するためのミトコンドリア標的マイクロニードルのメカニズム
乳がん腫瘍の微環境は、弱酸性かつ過酸化水素(H₂O₂)濃度が高いという特徴があります。この環境下では、HDT-Z@MNs中のDOX-TPP@ZIF-67ナノ粒子が分解し、薬剤DOX-TPPを制御的に放出します。DOX-TPPは、TPP(トリフェニルホスホニウム)基によるミトコンドリア標的能を持ち、放出された薬剤はミトコンドリア内に集積します(図5参照)。
その作用機序は二重の経路で進行します:
①ミトコンドリア機能障害を誘発し、活性酸素(Reactive Oxygen Species, ROS)を大量に生成。これにより細胞凋亡(Apoptosis)を誘導。
②一方で、グルタチオン(Glutathione, GSH)を消費してGPX4酵素を不活性化し、脂質過酸化とROSの増加を引き起こし、鉄依存性細胞死(Ferroptosis)を誘導。
すなわち、ミトコンドリア恒常性を破壊し、酸化ストレスを増幅させることで、細胞凋亡と鉄死の両経路を協調的に活性化し、耐薬性乳がん細胞を効果的に死滅させます。
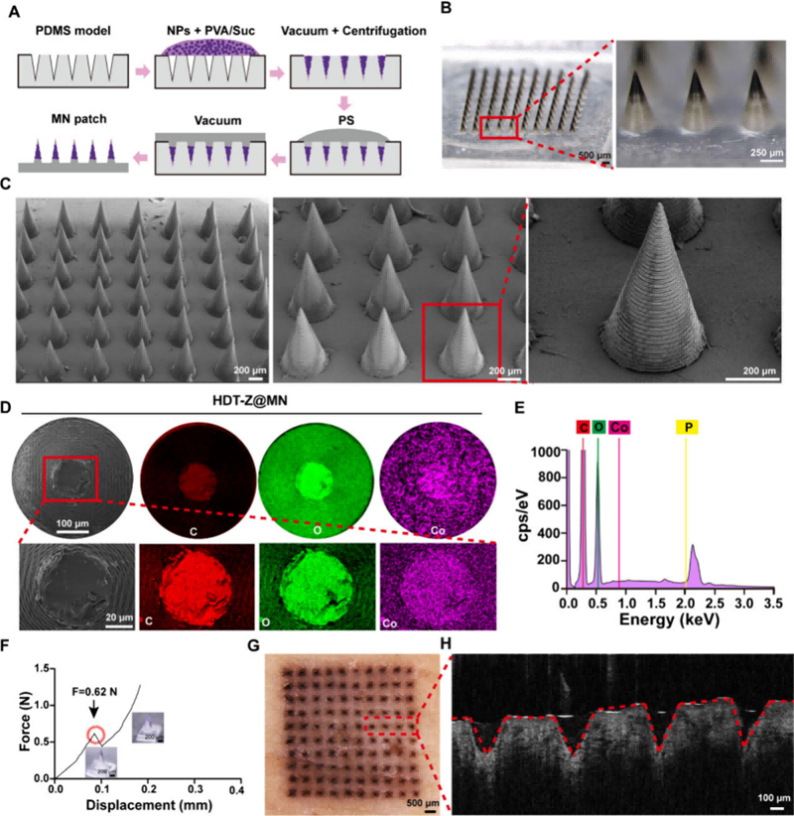
図6 中空DOX-TPP@ZIF-67ナノ粒子を負荷したナノ粒子(HDT-Z@MNs)の特性評価
この薬剤搭載型マイクロニードル(HDT-Z@MNs)は、BMF microArch® S240装置によって作製された高精度モールドを用い、PDMS転写法により作製されました。
まず、DOX-TPP@ZIF-67ナノ粒子をPVA/スクロース基材と混合し、PDMSモールドに充填して水溶性マイクロニードルを作製。その後、ポリスチレン(Polystyrene, PS)で背板層を形成し、完全なマイクロニードルアレイを得ました。
このマイクロニードルアレイは10×10の配列で構成され、針の高さは850 μm、底部直径は400μm、針間距離は700μmとなっています。
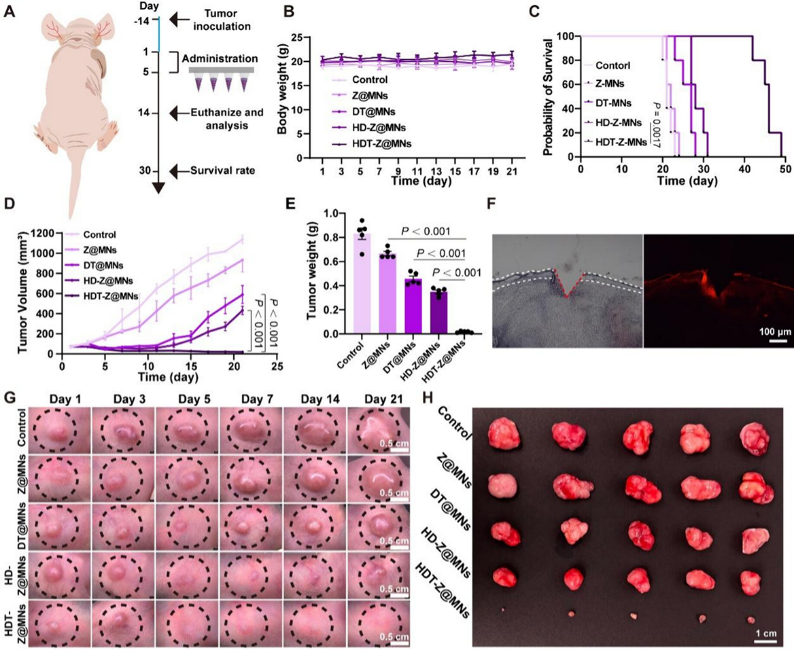
図7 皮下ドキシサイクリン耐性乳癌モデルにおけるHDT-Z@MNsの生体内抗腫瘍効果評価
研究チームは、阿霉素(DOX)耐性および感受性乳がん細胞を用いて、このマイクロニードルシステムの抗腫瘍効果を評価しました。
その結果、HDT-Z@MNsは細胞に高効率で取り込まれ、ミトコンドリアへ精密に送達され、ミトコンドリア障害の誘導、活性酸素生成、グルタチオン枯渇、GPX4抑制を通じて、細胞凋亡と鉄死を同時に活性化。これにより、がん細胞の増殖・移動・浸潤が大幅に抑制されました。
さらに、耐薬性および感受性乳がんを持つマウスモデルでのin vivo試験では、マイクロニードルパッチを腫瘍部位に局所適用することで、薬剤が腫瘍深部まで効果的に送達され、腫瘍増殖を強力に抑制し、マウスの生存期間を有意に延長しました。その作用は、腫瘍細胞のアポトーシス促進および上皮−間葉転換(Epithelial-Mesenchymal Transition, EMT)抑制によるものと考えられています。また、治療期間中、マウスの体重は安定し、主要臓器に損傷は見られず、高い治療効果と安全性が確認されました。
研究意義
本研究で開発されたミトコンドリア標的マイクロニードルシステムは、薬剤をミトコンドリアへ精密に送達し、アポトーシスとフェロトーシスの二重経路を協調的に活性化することで、乳がんのドキソルビシン耐性を効果的に克服しました。これにより、全身的な副作用を大幅に低減しながら、強力な抗腫瘍効果を発揮。本技術は、メカニズム革新から臨床応用への橋渡しとして、次世代の精密抗がん治療戦略に新たな方向性を提示しています。
4. まとめ
3Dプリンティング技術は、その高精度とカスタマイズ能力により、精密医療の発展を力強く推進しています。
この技術によって構築されたインプラントや生物組織モデルなどは、診断と治療の正確性と効率性を向上させ、医療モデルを「大量生産」から「個別化カスタム」への革命的な飛躍を実現しました。
今後、生体材料や印刷精度のさらなる進化、そして人工知能やバイオセンシングとの深い融合を通じて、3Dプリンティング技術は精密医療と再生医療の未来を根本から再構築することが期待されています。







